中央研究院 生物化學研究所
中央研究院 生物化學研究所
中央研究院 生物化學研究所

 中央研究院 生物化學研究所
中央研究院 生物化學研究所
代謝重編是癌症的一個特徵。 癌細胞會藉由改變各種細胞代謝途徑,以滿足其對生物能量和生物合成的高度要求,並適應惡劣的腫瘤微環境。 然而,目前尚不清楚癌細胞是否可以利用其他策略調控代謝來維持其增殖和存活。
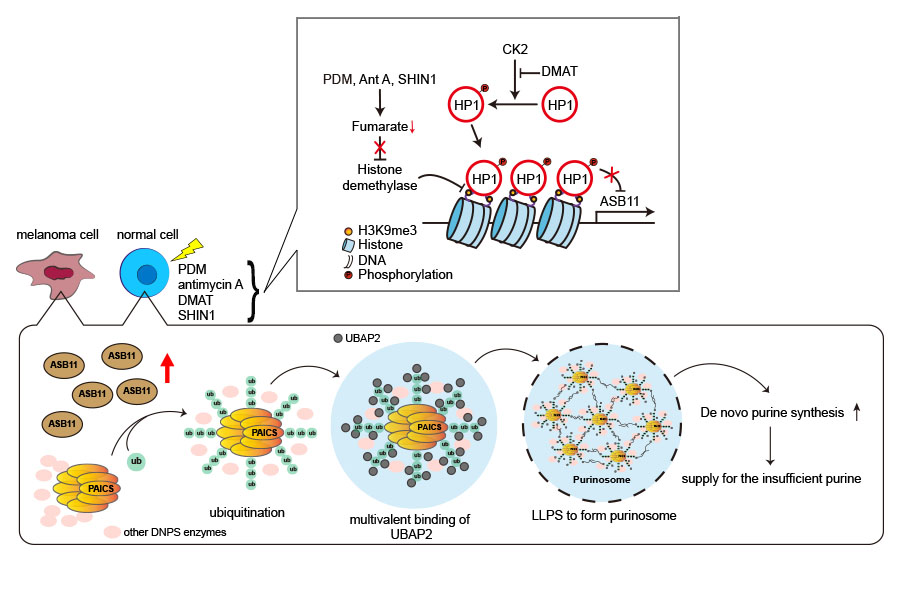
嘌呤體為一種生物分子縮合物,其形成可增強 DNPS 途徑通量。 然而,嘌呤體的組裝機制和病理生理功能尚不清楚。 陳瑞華博士的團隊發現了第一個嘌呤體組裝機制。 在數種嘌呤體誘導訊號刺激下, 會藉由上調ASB11組成之泛素連接酶促進 PAICS(DNPS 途徑中的一種八聚酶)進行以 K6位點連接之多泛素化。 而此種泛素化的 PAICS 可招募與泛素結合的無序蛋白 UBAP2 來促成多價結合,進而誘導液-液相分離和嘌呤體組裝。 團隊也發現黑色素瘤細胞透過高水平的表達ASB11而持續形成嘌呤體,且黑色素瘤細胞仰賴嘌呤體形成以提供充足嘌呤支持其增殖和存活。 這項研究揭示了代謝酶區室化對人類惡性腫瘤的影響,並強調了嘌呤體靶向作為抗癌策略的潛力。
本文共同第一作者為博士生周明杰及研究助理王苡瑄,論文已發表在《分子細胞》雜誌。
論文名稱:PAICS ubiquitination recruits UBAP2 to trigger phase separation for purinosome assembly
論文連結:https://doi.org/10.1016/j.molcel.2023.09.028
作者群:Chou MC, Wang YH, Chen FY, Kung CY, Wu KP, Kuo JC, Chan SJ, Cheng ML, Lin CY, Chou YC, Ho MC, Firestine S, Huang JR, Chen RH*