中央研究院 生物化學研究所
中央研究院 生物化學研究所
BRCA1-associated protein 1 (BAP1)是重要的腫瘤抑制因子,它屬於人類泛素碳端水解酶 (ubiquitin C-terminal hydrolase, UCH)家族成員之一。BAP1藉由移除轉譯後修飾泛素化(deubiquitination)的蛋白質標示,調控多種重要細胞生理功能,其中包括基因轉錄表達調控、染色質重塑、細胞週期進程、細胞分化凋亡、DNA損傷反應和修復。臨床醫學研究發現多種人類惡性腫瘤都帶有BAP1基因突變,其中包括惡性間皮瘤、葡萄膜黑色素瘤、腎透明細胞癌。許多癌症相關基因突變破壞BAP1去泛素化的酵素活性,影響BAP1進入細胞核執行正常生理功能的能力。因此BAP1已在臨床癌症研究被視為重要的風險因子。由於BAP1抑細胞癌化功能取決於其酵素活性和正確的細胞分佈,因此透過觀察BAP1在病患檢體細胞內定位染色結果也成為預測上述惡性癌症術後痊癒的指標。
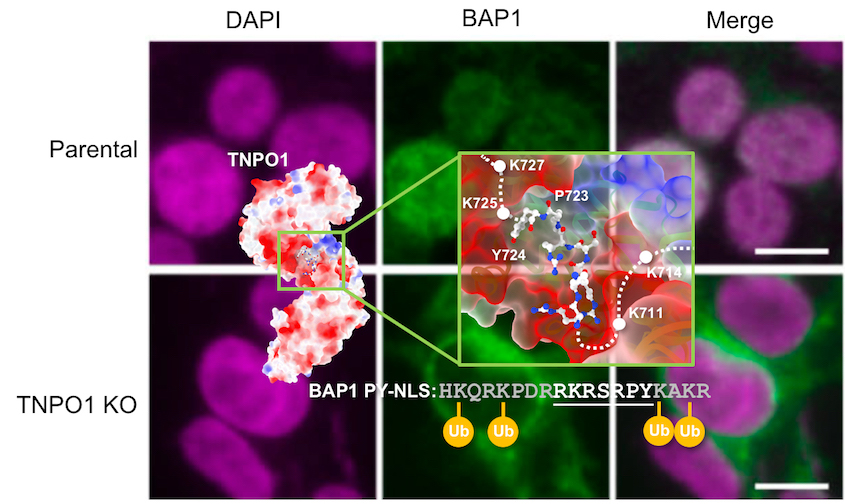
雖然臨床與細胞生物實驗均有充分資訊顯示BAP1需要正確引入細胞核內進行生理功能調控,但BAP1如何被有效帶入細胞核的分子調控機制尚未明確。中央研究院生物化學研究所徐尚德研究員與同所凌嘉鴻助研究員及吳昆峯助研究員以及清華大學分子與細胞生物研究所王慧菁教授進行團隊合作研究,結合基因編輯、活體細胞影像分析、結構生物學以及生物理化學分析方法探討BAP1進入細胞核的分子機轉。首先以質譜結合免疫沈澱分析法在眾多人體蛋白中發現一非典型核轉運蛋白Tranportin-1 (TNPO1)藉由辨識BAP1氨基酸序列末端的一段非典型核定位序列(nuclear localization sequence, NLS)協助BAP1進入至細胞核內執行其生理功能。接著透過國家同步輻射研究中心建置的新穎「台灣光子源」X光蛋白質單晶繞射實驗設施建立TNPO1與BAP1 NLS結合的分子立體模型,進而從原子層面闡述兩蛋白質交互作用的分子機制。配合一系列基因編輯、活體細胞影像分析以及生物物理實驗分析,該結構模型也可以解釋TNPO1如何透過與BAP1結合所產生的立體空間障礙的關係與一種非典型E2/E3泛素結合酶UBE2O競爭BAP1的核定位序列,避免UBE2O對BAP1進行單泛素化(NLS monoubiquitination)轉譯後修飾導致BAP1累積至細胞質而無法順利在細胞核內執行基因表達轉譯調控的重要生理功能。該成果已發表在全球頂尖期刊《細胞生物學雜誌 Journal of Cell Biology》。